当我们对人体免疫系统各种机制和细胞信号通路了解得越多,我们就越是发现,关于疾病、癌症,乃至寿命,人体自身就可能包含着这些问题的最终答案。原文首发于大象公会-混乱博物馆的科普短视频,请点击链接。
我们曾经讲过,癌细胞是如何狡猾地欺骗了你的身体,逃过免疫细胞的搜捕。其实,人体免疫系统本身就有一套非常高效的敌我识别系统、情报提取与传递系统、快速响应部队和后续援军,正常人体内绝大多数基因突变的受损细胞都被免疫系统清除了。
那么,我们能不能加强免疫细胞的能力,来消灭肿瘤细胞呢?答案是肯定的,这就是肿瘤疗法中最前沿,也是最具挑战性的免疫疗法。比如人们发现,巡逻的免疫细胞T细胞之所以不攻击肿瘤细胞,是由于肿瘤细胞利用自己的细胞程序死亡-配体1——PD-L1,关掉了T细胞身上的细胞程序死亡蛋白-1——PD-1,从而抑制了免疫信号传导。这就是一个免疫检查点,原本是为了避免免疫系统无差别攻击自身细胞而设置的停车检查程序,但却被这些叛徒肿瘤细胞利用。明白了这些,人类才有可能开发阻断PD-1/PD-L1识别的抑制剂,让T细胞重新认清肿瘤细胞的真面目,从而激活一系列的免疫响应事件,利用人体自身免疫系统杀死肿瘤细胞。
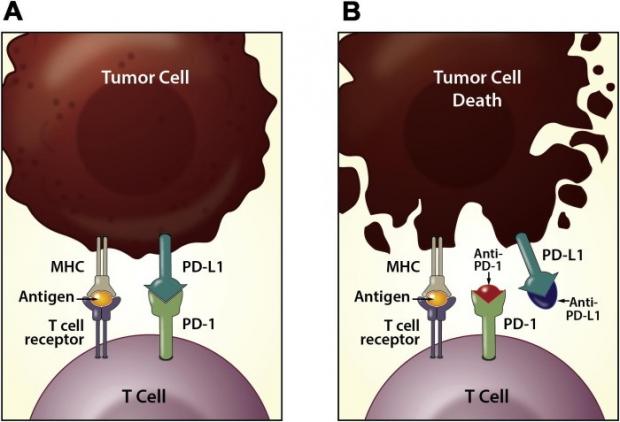
2014年,首个人源化抗PD-1的纳武利尤单抗(Nivolumab,商品名Opdivo)被批准上市。它能够结合并阻断位于免疫细胞上的PD-1,让肿瘤细胞上的PD-L1蛋白无处下手,免疫逃逸机制也就失效了。同年,帕博利珠单抗(Pembrolizumab,商品名Keytruda)也被批准上市。这些药物相当于废除了PD-1这个免疫检查点,可用于治疗多种癌症,包括黑色素瘤、肺癌、肾癌、膀胱癌、头颈癌、霍奇金淋巴瘤等。这也就是著名的O药和K药。紧接着,卡瑞利珠单抗、特瑞普利单抗、替雷利珠单抗,这些由我国自主研发的PD-1抑制剂也陆续通过药品监管部门的审批。此外,人们也开发了诸多PD-L1的抑制剂,用于中和肿瘤细胞表面的「钥匙」。近十年来,各种针对PD-1/PD-L1抑制剂是肿瘤药物研发的热点,核心目的都是为了唤醒沉睡在T细胞体内的「原力」。
另外一个重要的免疫检查点叫做CTLA-4。当免疫系统的情报员,也就是抗原提呈细胞(antigen presenting cell,APC)送来了紧急敌情电报,也就是B7分子,与T细胞表面的激活因子CD28结合,产生共刺激信号(co-stimulation),激发 T 细胞分化、增殖,以及分泌白血球介素2 ——IL-2等细胞因子,放大免疫系统的反应;而细胞毒性T淋巴细胞相关蛋白4——CTLA-4会与T细胞激活因子CD28竞争性抢夺B7分子,且其亲和力要高出十几倍。这样就抑制了T细胞的增殖与活化,并进一步传递抑制信号,减少白血球介素2(IL-2)与干扰素-γ(IFN-γ)分泌。
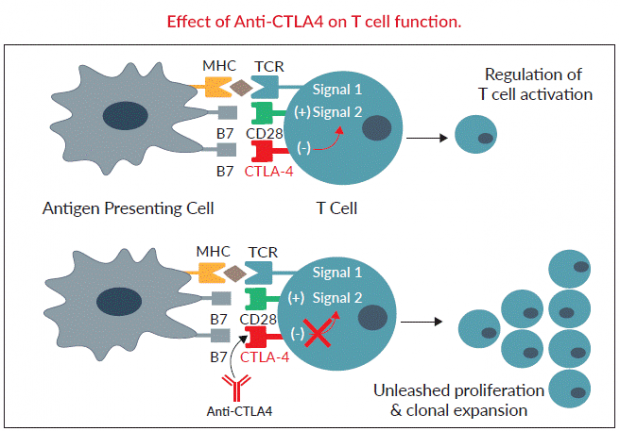
在正常人的体内,它的作用就如同刹车,CTLA-4通过下调免疫响应,可以避免系统飙车过快导致车毁人亡。但是对于肿瘤患者,我们当然希望免疫系统可以稍微卖力一些,甚至激进一点点,才能清除变异的肿瘤细胞。 2011年,FDA批准了伊匹单抗(Ipilimumab,商品名:Yervoy)。这种药物可以阻断CTLA-4,相当于部分地锁死了人体免疫系统的刹车制动,让它们全功率运作,进而消灭肿瘤细胞。目前CTLA-4伊匹单抗已经批准用于治疗黑色素瘤,与PD-1/PD-L1抗体联用的临床试验也正在进行中。
甚至可以将PD-1/PD-L1抑制剂与CTLA-4抑制剂连用,前者帮助免疫系统识破肿瘤细胞的伪装,后者加强T细胞的增殖,双管齐下,可能是比两种抑制剂各自单独使用,更加有效的治疗方案。一般来说,免疫检查点疗法的副作用也远小于标准化疗。
免疫疗法还有一个听起来更加科幻的方向:先从人体内提取免疫细胞,然后对其进行基因工程改造,加上能够识别肿瘤细胞的嵌合抗原受体(CAR,chimeric antigen receptor),并在体外完成大量增之后,输回患者体内。这被称为「免疫细胞疗法」。与一些骗人钱财乃至性命的虚假免疫细胞疗法不同,免疫细胞疗法成功的关键在于基因工程改造,人工加上能够精确制导的嵌合抗原受体,使其专杀肿瘤细胞,单纯体外增殖免疫细胞是没有用的。
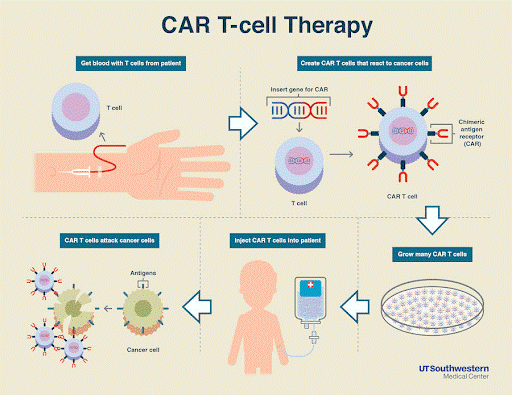
目前,CAR-T细胞疗法已经通过FDA审批,用于治疗难治性非霍奇金淋巴瘤和儿童复发急性成淋巴细胞性白血病。应用于其他更多种类肿瘤的治疗仍处于研究阶段,但已经表现出巨大的潜力。这些CAR-T细胞甚至在攻击肿瘤细胞之后,仍然能够留在患者体内,形成记忆。一旦肿瘤细胞再次出现,免疫细胞就能及早识别、进行追杀,因而也避免了癌症的复发。除此以外,针对自然杀伤细胞(natural killer cell)的CAR-NK、巨噬细胞(macrophage)的CAR-M等等治疗方法,都是当下研究的热点。我们希望能够驯化多种具有不同杀伤能力的免疫细胞,用于攻克各种不同的癌症。细胞疗法已经被证明是一种副作用较小的疗法。然而输入大量的免疫细胞,还是可能会造成细胞因子风暴,带来发烧、头疼、呼吸困难,甚至意识混淆等情况。
正因为如此,免疫疗法究竟能够用于哪些肿瘤的治疗,并不能依靠人们的希望与畅想,而是必须有坚实的数据。只有药厂向监管部门提交足够的安全性、有效性证据,也就是通过严格的临床试验验证,获得审批之后,才能被广泛用于治病救人面对生命系统的复杂,尤其是肿瘤的狡猾与多变,我们永远不能轻敌,更加不可冒进。
参考文献
1. 叶森. 谈癌不色变-人人都能看得懂的防癌手册[M]. 北京: 清华大学出版社, 2018.
2. Zou, W.; Wolchok, J. D.; Chen, L., PD-L1 (B7-H1) and PD-1 pathway blockade for cancer therapy: Mechanisms, response biomarkers, and combinations [J]. Sci Transl Med, 2016, 8 (328), 328rv4.
3. Buchbinder, E. I.; Desai, A., CTLA-4 and PD-1 Pathways: Similarities, Differences, and Implications of Their Inhibition [J]. Am J Clin Oncol, 2016, 39 (1), 98-106.
4. 张巍, 董菲, 克晓燕. B7家族共刺激分子在血液系统恶性肿瘤中的研究进展 [J].中华血液学杂志, 2015, 36(7), 626-632.
5. 丹娜—法伯癌症研究所, CAR T-细胞疗法 [EB/OL], https://www.dana-
6. City of Hope, 用于脑肿瘤的 CAR T 细胞疗法 [EB/OL],
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 