原文首发于研发客-地平线专栏:
六七十年前,意大利的科研人员带着寻找土壤中的抗癌药物的任务,来到了蒙特城堡。他们希望这座神圣罗马帝国皇帝外出打猎时的居所能带来好运。令人兴奋的是,他们的确在附近一座兴建于13世纪的城堡分离到一种土壤样本,发现了一种霉菌菌株,能够制造红色染料。
染料代表金子般的机会
在早期制药领域,染料代表着金子一般的机会:不仅意味着分子有颜色,更重要的是能与某些生物分子紧密结合,从而抑制或促进某些生命活动。能够从自然界中提取染料或化工合成染料代表着一个国家最先进的科技,也是现代医药的基础。紧接着的动物实验和临床试验更是让科研人员惊喜,这种带有红宝石一般的鲜艳颜色的药物成功治疗了急性白血病和淋巴瘤,紧接着它被命名为柔红霉素,成为了当时的神药。
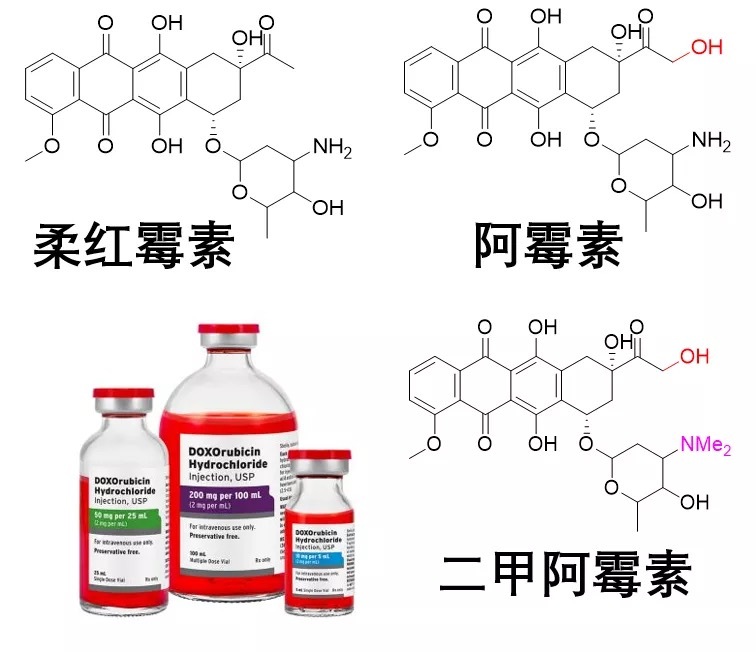
然而临床应用中,人们迅速发现柔红霉素能带来严重的副作用,最糟糕的是其足以致命的心脏毒性。那就让科学家大显身手,调控药物的结构,增强其抗癌活性,去除其心脏毒性吧!
难以忍受的副反应
科学家们延续了之前的好运,随后的实验证明:突变了的链霉菌产生了更加有效的红色药物——阿霉素。事实上,阿霉素在分子结构上只比柔红霉素多一个羟基。开局看上去很不错,人们连续发现了两种有效的阿霉素类药物。
过去几十年间,科学家们探究了超过2000种阿霉素类似物(合成化学家在此发挥了重要作用)。阿霉素几乎可以用于治疗所有肿瘤,也可以与别的化疗药物搭配,直到今天也是最有效的化疗药物之一。然而,阿霉素仍有心脏毒性。人们再也没有发现比阿霉素更有效的药物了,也总是无法摆脱心脏毒性的阴影。
目前,全球每年有100万病人服用这种60年前发现的药物,忍受着恶心、呕吐和心律不齐的副作用。医生们也要密切监察病人用药:高剂量药物能够杀死肿瘤细胞,但严重的副作用会导致心衰竭、心肌病甚至死亡。一些高风险患者,尤其是年长患者往往无法承担这些副作用,这极大地限制了阿霉素类药物的进一步使用。
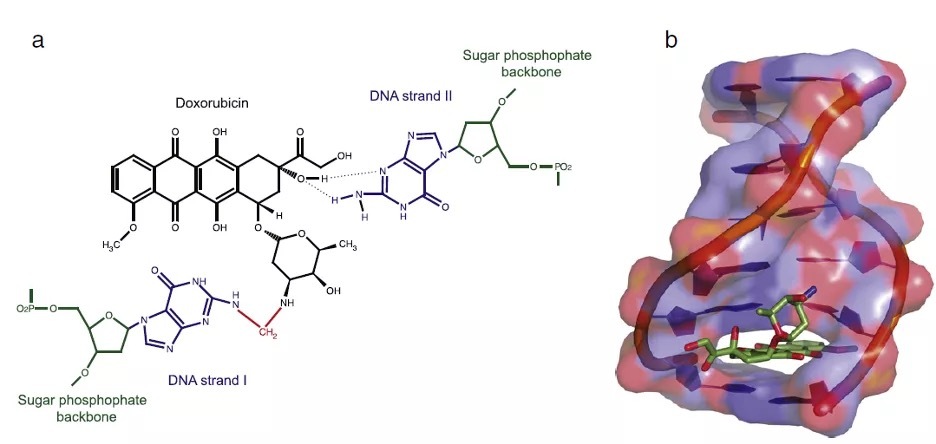
阿霉素与DNA作用示意图,Kemp & Henikoff (CC-BY-NC-SA)
知己知彼,百战不殆。明白了阿霉素的作用机制,我们才有可能发挥其疗效,又避免其心脏毒性。过去几十年的生物机制研究表明:阿霉素能够插入DNA双链,抑制解开DNA超螺旋结构的拓扑异构酶II,螯合铁离子并产生大量氧自由基,造成DNA损伤断裂。这种对DNA的损伤是抗癌药效的基础,但也会对心脏细胞造成无法避免的无差别打击。
为了降低副作用,强生公司甚至开发了脂质体包裹的阿霉素缓释药物,希望能将药物富集在肿瘤组织附近、低浓度地缓慢释放,然而却无法解决心脏毒性的问题。使用抗氧化剂来保护心肌细胞的临床试验也没获得良好的效果。看上去,科学家们已经无计可施;严重的心脏毒性是病人在化疗过程中不可避免的风险。
二甲阿霉素柳暗花明?
尽管苦难重重,但人类没有放弃努力。近些年来,科学家阐明了阿霉素药物抗癌新机制:驱赶组织蛋白,造成染色质损伤。一些不会引发DNA损伤,但能够造成染色体损伤的阿霉素类药物也能够获得良好的抗癌效果。科学家们发现将阿霉素分子上的氨基(-NH2)变为二甲胺基(-NMe2)的奇特疗效——二甲阿霉素不会抑制拓扑异构酶II,也不会导致DNA断裂。
按照过去的筛药标准,这种药物是不符合抗癌机制的无效药物,在细胞筛选的时候就会被抛弃,根本就不会进入动物实验。然而,新的染色体损伤实验证明:二甲阿霉素能够有效破坏细胞内的组织蛋白,造成染色质损伤。进一步的动物实验也证实了二甲阿霉素与阿霉素的抗癌活性相似,却没有心脏毒性,不会造成心律不齐与心脏衰竭。
在笔者看来,二甲阿霉素不会造成DNA损伤的分子基础在于其二甲胺基的结构修饰。传统的阿霉素能够插入DNA的GC序列,并形成阿霉素-DNA加合物。这个过程的第一步是氢键的诱导,紧接着被新生成的共价键稳定(上图中的红色亚甲基是新生成的共价键)。
阿霉素的氨基能够与细胞内源产生的甲醛分子缩合,又进一步与鸟嘌呤的氨基缩合,生成这样稳定的阿霉素-鸟嘌呤加合物,造成DNA损伤。有趣的是,某些对阿霉素治疗有响应的肿瘤细胞内确实发现了较高水平的甲醛分子。通过结构修改,二甲阿霉素的氨基上已经有了两个甲基,无法与甲醛反应,也就不可能再与鸟嘌呤的氨基生成稳定的共价加合物。因此,二甲阿霉素无法造成进一步的DNA断裂损伤,在动物实验中也没有表现出心脏毒性。然而,二甲阿霉素与DNA的氢键作用仍然存在,仍然能够可逆地插入DNA碱基对来驱赶组织蛋白,损伤细胞染色质,这样就在降低心脏毒性的同时,保留了抗癌功效。
这项重大研究由尼兰德癌症研究院的Xiaohang Qiao博士主导,发表在《美国科学院院刊》杂志上,给100万服用阿霉素药物的病人带来了新的希望:对于这种红色毒药,我们一定能够取其疗效,避其毒性。
结论
过去60多年,人们总是执着于寻找能够造成DNA损伤的阿霉素类药物,但随之而来的心脏毒性总是无法避免。新的抑癌机制的发现也给药物研发带来了新的机会。了解更多生命的奥秘之后,我们再回头看,总是会有老树开花的新惊喜。在大家的注意力都集中在靶向药物与免疫疗法的时候,也要注重传统的药物化学构效关系基于最新的肿瘤生物学基础的研究。如果再回头筛查那些无法损伤DNA但能损伤染色质的阿霉素类药物甚至更多的化学药物,是否会有新的发现呢?
参考文献:
1. Qiao, X.; van der Zanden, S. Y.; Wander, D. P. A.; Borràs, D. M.; Song, J.-Y.; Li, X.; van Duikeren, S.; van Gils, N.; Rutten, A.; van Herwaarden, T.; van Tellingen, O.; Giacomelli, E.; Bellin, M.; Orlova, V.; Tertoolen, L. G. J.; Gerhardt, S.; Akkermans, J. J.; Bakker, J. M.; Zuur, C. L.; Pang, B.; Smits, A. M.; Mummery, C. L.; Smit, L.; Arens, R.; Li, J.; Overkleeft, H. S.; Neefjes, J., Uncoupling DNA damage from chromatin damage to detoxify doxorubicin. Proceedings of the National Academy of Sciences 2020, 117 (26), 15182.
2. Kaiser, J., A colorful chemotherapy agent could be made less toxic. Science 2020, 369 (6499), 18.
3. Yang, F.; Teves, S. S.; Kemp, C. J.; Henikoff, S., Doxorubicin, DNA torsion, and chromatin dynamics. Biochimica et Biophysica Acta (BBA) - Reviews on Cancer 2014, 1845 (1), 84-89.
4. Weiss, R. B., The anthracyclines: will we ever find a better doxorubicin? Seminars in oncology 1992, 19 (6), 670-86.
0
推荐




 京公网安备 11010502034662号
京公网安备 11010502034662号 